
Inhoud
- stadia
- Methode 1 Een vergelijking afwegen met de methode van vallen en opstaan
- Methode 2 Vergelijk een vergelijking met de algebraïsche methode
In de chemie stelt een vergelijking vast wat er gebeurde tijdens een chemische reactie. Links van de vergelijking plaatsen we de reagentia die voor het experiment zijn gebruikt en rechts de producten die tijdens het experiment zijn verkregen. Volgens het principe van behoud van de massa (Lavoisier) tijdens een chemische reactie verdwijnt er geen atoom, wordt er geen gecreëerd, combineren ze anders. Samenvattend moet u voor elk element rechts hetzelfde aantal gegevens hebben als links van de vergelijking. Daarom moet een evenwichtsvergelijking altijd in evenwicht zijn.
stadia
Methode 1 Een vergelijking afwegen met de methode van vallen en opstaan
-
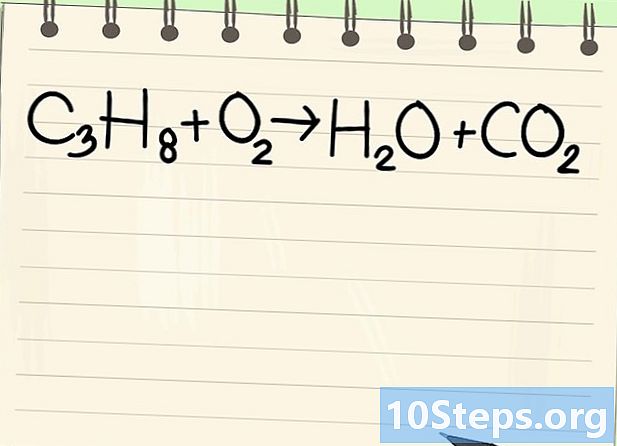
Let op de balansvergelijking. We zullen de volgende vergelijking behandelen:- C3H8 + O2 -> H2O + CO2
- Dit is de vergelijking van propaanverbranding (C3H8) in zuurstof: water en kooldioxide worden verkregen.
-
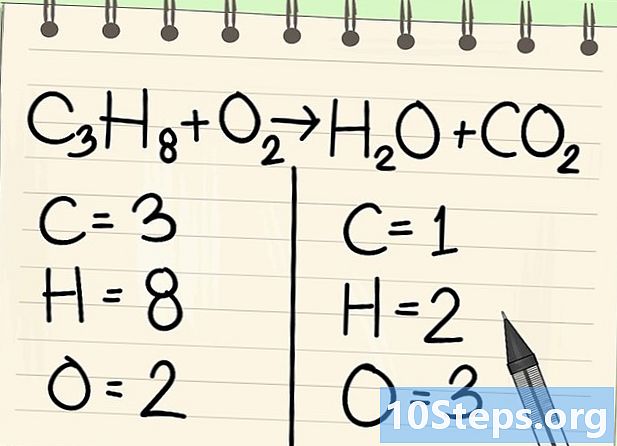
Tel de atomen. Voer het aantal gegevens in van elk element aan de ene kant van de vergelijking en vervolgens de andere. Houd hierbij rekening met de indices, als er geen is, is de index 1.- Links zijn er 3 koolstofatomen, 8 waterstof en 2 zuurstof.
- Aan de rechterkant is er 1 atoom koolstof, 2 waterstof en 3 zuurstof.
-
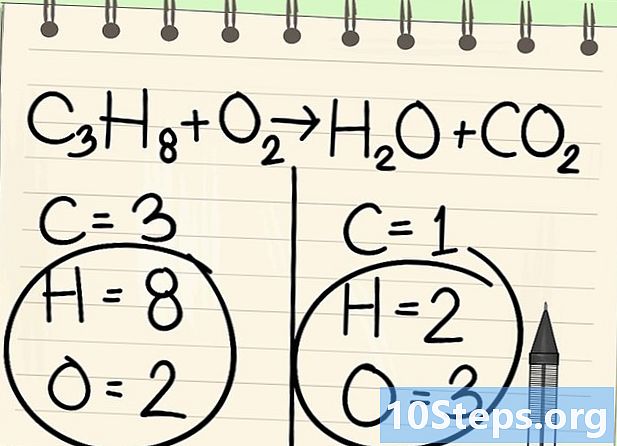
Laat even de waterstof en de zuurstof weg. -

Begin met balanceren met het juiste element. We beginnen altijd met die in een molecule voor en na de reactie. Als er meerdere zijn, neem dan degene die monovalent is in een van de moleculen. Hier beginnen we met de koolstofatomen. -

Breng de koolstofatomen in evenwicht. Voeg aan de rechterkant een coëfficiënt toe aan het koolstofdioxidemolecuul (CO2) waarin het koolstof-latoom alleen is. We zullen een 3 plaatsen om de 3 linker atomen te krijgen.- C3H8 + O2 -> H2O + 3CO2
- We hebben dus 3 koolstofatomen aan de rechterkant dankzij de coëfficiënt (3CO2) en 3 koolstofatomen links dankzij de index (C3H8).
- In een vergelijking kun je alle gewenste coëfficiënten invoeren, maar je kunt de aanwijzingen niet aanraken.
-
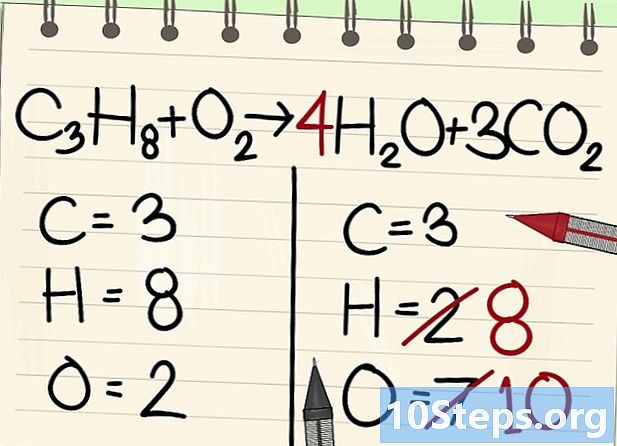
Breng de waterstofatomen in evenwicht. Omdat je nog 8 over hebt van de vergelijking, heb je net zoveel nodig.- C3H8 + O2 --> 4H2O + 3CO2
- Aan de rechterkant zet je een coëfficiënt van 4, omdat de waterstof bivalent is in het watermolecuul: de index 2 geeft aan dat twee waterstofatomen zijn geassocieerd.
- Om het aantal waterstofatomen aan de rechterkant te verkrijgen, vermenigvuldigt u de coëfficiënt 4 met de index 2, of 8 atomen.
- Wat de atomen van zuurstof betreft, er zijn er nu 6 aan één kant, afkomstig van de drie moleculen van 3CO2 (3 x 2 = 6 atomen) en 4 van de 4 moleculen van 4H2O (4 x 1 = 4 atomen), dwz een totaal van 10 atomen zuurstof.
-
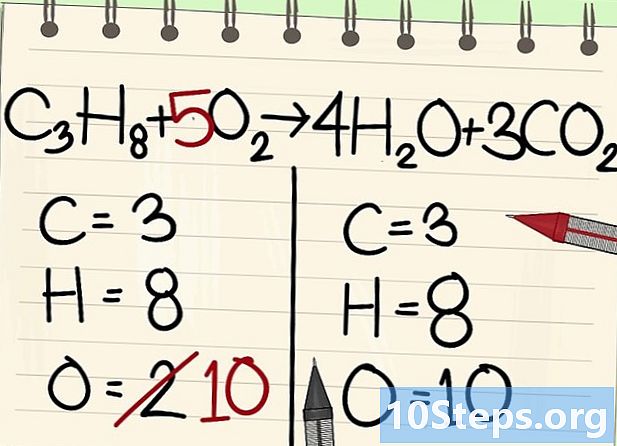
Breng de atomen van zuurstof in evenwicht.- Vanwege de koolstof- en waterstofbalans is het aantal zuurstofatomen niet hetzelfde aan beide zijden van de vergelijking. We zagen eerder dat er rechts 10 zuurstofatomen waren (4 uit watermoleculen en 6 uit koolstofdioxidemoleculen). Aan de linkerkant zijn er slechts 2 (van O2).
- Om de zuurstof in balans te brengen, voeg je een coëfficiënt van 5 toe aan het linker zuurstofmolecuul: je hebt 10 zuurstofatomen links en de andere rechts.
- C3H8 + 5O2 -> 4H2O + 3CO2
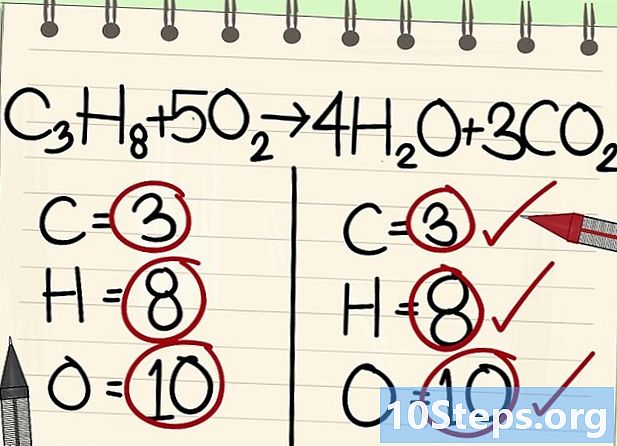
- Alle atomen (koolstof, waterstof en zuurstof) zijn evenwichtig: uw vergelijking is evenwichtig.
Methode 2 Vergelijk een vergelijking met de algebraïsche methode
-

Schrijf de vergelijking om te balanceren. Wijs elke molecule een letterlijke coëfficiënt toe. We zullen ze bellen heeft, b, c en d. -
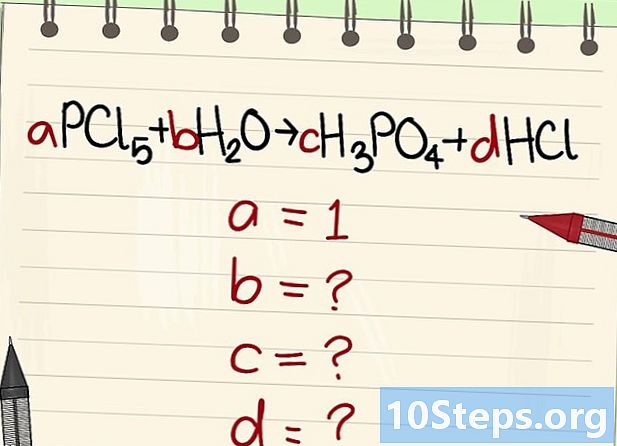
Vind de waarde van de andere letterlijke coëfficiënten. Dat zullen we vragen heeft = 1. -

Vind de relaties tussen deze coëfficiënten. Kijk naar links (reagentia) en rechts (producten) en leg de relaties tussen deze verschillende coëfficiënten vast.- Neem de volgende vergelijking: aPCl5 + bH2O = cH3PO4 + dHCl. Er is gezegd dat a = 1, wat betekent dat c = a, d = 5a en 2b = 3c + d. Berekeningen gedaan, c = 1, d = 5 en b = 4.

- Neem de volgende vergelijking: aPCl5 + bH2O = cH3PO4 + dHCl. Er is gezegd dat a = 1, wat betekent dat c = a, d = 5a en 2b = 3c + d. Berekeningen gedaan, c = 1, d = 5 en b = 4.


