Inhoud
Hoewel alle atomen van hetzelfde element hetzelfde aantal protonen bevatten, kan het aantal neutronen variëren. Als u weet hoeveel neutronen een bepaald atoom heeft, kunt u bepalen of het deeltje regelmatig is in dat element of een isotoop, die meer of minder neutronen bevat. Het bepalen van het aantal neutronen in een atoom is vrij eenvoudig en vereist geen experiment. Om het aantal neutronen in een normaal atoom of isotoop te berekenen, volgt u deze instructies met een periodiek systeem in de hand.
Stappen
Methode 1 van 2: Het aantal neutralen in een gemeenschappelijk atoom vinden
Zoek het element in het periodiek systeem. Laten we voor dit voorbeeld eens kijken naar het OS (Os), dat zich in de zesde rij bevindt, van boven naar beneden.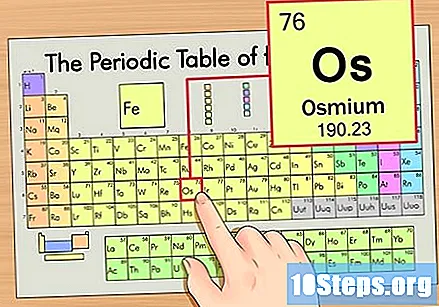
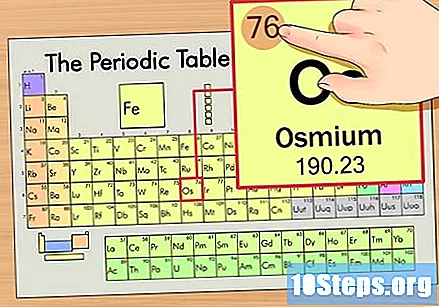
Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer voor een bepaald element en staat meestal boven het symbool (in de tabel die we gebruiken, staat er in feite geen ander nummer). Het atoomnummer is het aantal protonen in een enkel atoom van dat element. Het aantal Os is 76, wat betekent dat een Osmium-atoom 76 protonen heeft.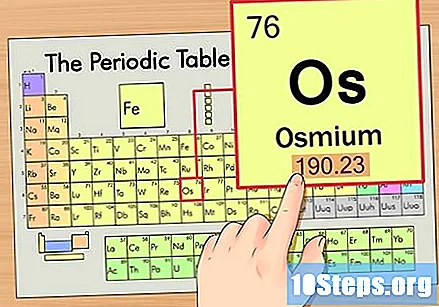
Zoek het atoomgewicht van het element. Dit nummer staat meestal onder het atoomsymbool. Merk op dat de tabel in dit voorbeeld alleen is gebaseerd op het atoomnummer en niet het atoomgewicht vermeldt. Dit zal niet altijd het geval zijn. Osmium heeft een atoomgewicht van 190,23.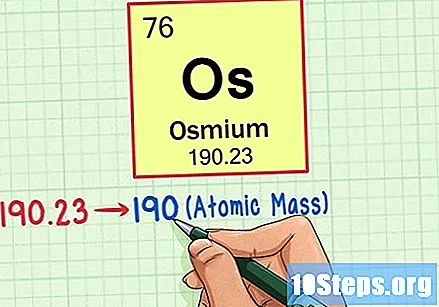
Rond het atoomgewicht af op het dichtstbijzijnde gehele getal om de atoommassa te vinden. In ons voorbeeld zou 190,23 worden afgerond op 190, wat resulteert in een atoommassa van 190 voor Osmium.- Atomaire massa is een gemiddelde van de isotopen van het element. Daarom is het meestal geen geheel getal.
Trek het atoomnummer af van de atoommassa. Aangezien de overgrote meerderheid van de massa van een atoom wordt aangetroffen in zijn protonen en neutralen, geeft het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa het aantal berekend van neutronen in het atoom. Het getal achter de komma vertegenwoordigt over het algemeen een zeer kleine massa elektronen in het atoom. In ons voorbeeld is dit: 190 (atomaire massa) - 76 (aantal protonen) = 114 (aantal neutronen).
Onthoud de formule. Gebruik deze formule om het aantal neutronen in de toekomst te vinden: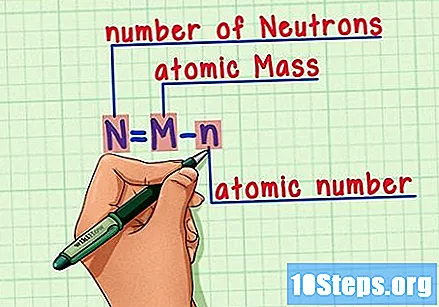
- N = M - n.
- N = aantal Neutrons.
- M = M.atomair gebraden.
- n = natomaire humerus.
- N = M - n.
Methode 2 van 2: Het aantal neutronen in een isotoop vinden
Zoek het element in het periodiek systeem. Laten we bijvoorbeeld de koolstof-14-isotoop gebruiken. Aangezien de niet-isotopische vorm van koolstof-14 gewoon Koolstof (C) is, zoek dit element op in het periodiek systeem (in de tweede rij).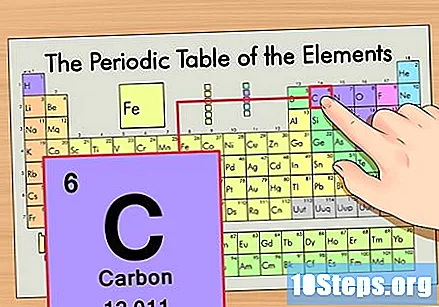
Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer voor een bepaald element en staat meestal boven het symbool (in de tabel die we gebruiken, staat er in feite geen ander nummer). Het atoomnummer is het aantal protonen in een enkel atoom van dat element. C is nummer 6, wat betekent dat een koolstofatoom 6 protonen heeft.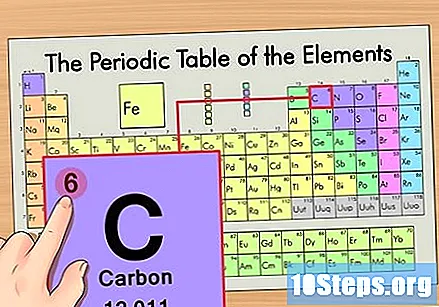
Vind de atomaire massa. Dit is ongelooflijk eenvoudig met isotopen, omdat ze zijn vernoemd naar hun atomaire massa. Koolstof-14 heeft een atoommassa van 14. Als je eenmaal de atoommassa van de isotoop hebt gevonden, is het proces voor het vinden van het aantal neutronen hetzelfde als dat voor gewone atomen.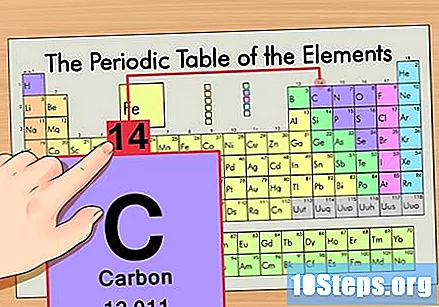
Trek het atoomnummer af van de atoommassa. Aangezien de overgrote meerderheid van de massa van een atoom wordt aangetroffen in zijn protonen en neutralen, geeft het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa het aantal berekend van neutronen in het atoom. Het getal achter de komma vertegenwoordigt over het algemeen een zeer kleine massa elektronen in het atoom. In ons voorbeeld is dit: 14 (atomaire massa) - 6 (aantal protonen) = 8 (aantal neutronen).
Onthoud de formule. Gebruik deze formule om het aantal neutronen in de toekomst te vinden: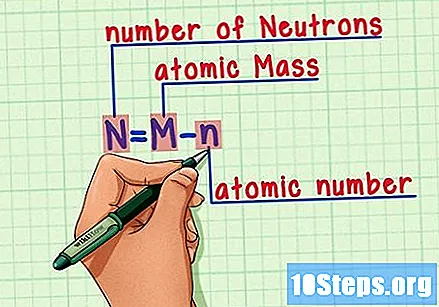
- N = M - n.
- N = aantal Neutrons.
- M = M.atomair gebraden.
- n = natomaire humerus.
- N = M - n.
Tips
- Osmium, een vast metaal bij kamertemperatuur, ontleent zijn naam aan het Griekse woord voor 'geur', 'osme'.
- Protonen en neutronen vormen bijna het volledige gewicht van de elementen, terwijl elektronen en andere diverse deeltjes een verwaarloosbare massa vertegenwoordigen (bijna nul massa). Omdat een proton ongeveer hetzelfde gewicht heeft als een neutraal en het atoomnummer het aantal protonen vertegenwoordigt, kunnen we eenvoudig het aantal protonen aftrekken van de totale massa.
- Als u niet zeker weet welk nummer dat is in het periodiek systeem, onthoud dan dat het meestal wordt gemaakt rond het atoomnummer (dat wil zeggen het aantal protonen), dat begint met 1 (waterstof) en één eenheid per van links naar rechts, eindigend in 118 (Ununóctio). Dit komt omdat het aantal protonen in een atoom bepaalt wat dat atoom is, waardoor het gemakkelijker wordt om het elementaire kenmerk te organiseren (een atoom met 2 protonen zal bijvoorbeeld altijd Helium zijn, net zoals een ander atoom met 79 protonen altijd Goud zal zijn).