
Inhoud
- stadia
- Methode 1 Ontwerp Lewis-structuren
- Methode 2 Toevoegen van stoffen aan oplosmiddelen
- Methode 3 Voer elektromagnetische compatibiliteitstests uit
Moleculen zijn groepen van atomen die binden. In sommige gevallen veroorzaken dergelijke verbindingen een ongelijke verdeling van elektrische ladingen door het molecuul, waardoor twee polen ontstaan, de ene positief en de andere negatief. Wanneer dit gebeurt, wordt het molecuul als polair beschouwd. Het is mogelijk om te bepalen of een molecuul polair is of niet door de bindingen tussen atomen te analyseren, door zijn reacties in contact met andere polaire stoffen te testen of door zijn gedrag te observeren bij blootstelling aan een elektromagnetisch veld.
stadia
Methode 1 Ontwerp Lewis-structuren
-

Schrijf de symbolen van de atomen van het molecuul. Raadpleeg het periodiek systeem om het symbool van elk atoom te vinden. De chemische symbolen worden gebruikt om de atomen in de Lewis-formule weer te geven. Pas op dat u ze niet verwart.- Om bijvoorbeeld de structuur van een watermolecuul weer te geven, schrijft u één O en twee H.
-

Ontdek wat het centrale atoom is. Het is het atoom waaraan alle (of bijna alle) andere elementen zijn gekoppeld. Dergelijke atomen kunnen al dan niet met elkaar in verband staan. Gewoonlijk heeft het centrale atoom een lage elektronegativiteit.- Het watermolecuul, dat zuurstof als centraal atoom heeft, is een uitzondering op de regel, hoewel het meer elektronegatief is dan waterstofatomen.
- Koolstofdioxide is bijvoorbeeld een molecuul waarvan het centrale atoom het minst elektronegatief is. Het is de koolstof die in dit geval het centrale atoom is.
-

Voeg alle chemische bindingen toe. Gebruik de byteregel om het aantal bindingen in het molecuul en hun type te bepalen. Elk atoom moet acht elektronen in de valentie laag hebben om stabiel te blijven. Sommigen van hen moeten twee of drie verbindingen maken om deze stabiliteit te bereiken.- Breng een verband tot stand tussen de zuurstof en elk van de waterstofatomen. Waterstofatomen binden niet aan elkaar.
-

Neem ongebonden elektronen op in de structuur. Hoewel de meeste elektronen worden gedeeld door chemische bindingen, hebben sommige atomen ongebonden elektronen. Deze elektronen moeten ook worden opgenomen in de Lewis-formule omdat ze een uiterst belangrijke rol spelen bij het bepalen van de polariteit van een molecuul. Maak punten rond de atomen om de elektronen weer te geven, al dan niet gerelateerd.- Het zuurstofatoom heeft twee paar niet-bindende elektronen, dat wil zeggen dat ze niet worden gebruikt voor binding, maar gebonden blijven aan zuurstof.
-
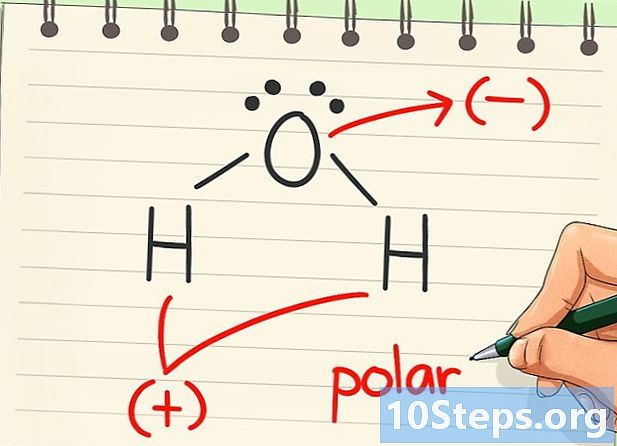
Kijk of het molecuul een dipool heeft. De dipolen treden op wanneer de elektronen ongelijk verdeeld zijn van de ene kant van het molecuul naar de andere. De aanwezigheid van een dipool betekent dat het molecuul polair is. Als de elektronen gelijkmatig zijn verdeeld, is het apolair.- Aangezien elektronen zich meer aangetrokken voelen tot zuurstof dan waterstof, hebben ze de neiging zich op die kant van het molecuul te concentreren. Dit veroorzaakt een negatieve lading voor zuurstof en een positieve lading voor waterstof, waardoor een dipool ontstaat en water in een polair molecuul verandert.
Methode 2 Toevoegen van stoffen aan oplosmiddelen
-

Vul een beker met water. Water is een polair oplosmiddel: doe 100 ml in een schone beker en laat deze later staan. -

Voeg nog een niet-polair oplosmiddel toe aan een ander bekerglas. Enkele voorbeelden van apolaire oplosmiddelen zijn benzine, tolueen en oliën in het algemeen. Giet 100 ml niet-polair oplosmiddel in een ander bekerglas en laat het naast het eerste bekerglas staan.- Veel apolaire oplosmiddelen zijn vluchtige organische stoffen (VOS) en kunnen behoorlijk gevaarlijk zijn. Wees voorzichtig bij het verwarmen en draag handschoenen en een masker om uzelf te beschermen.
- Plantaardige olie is een niet-vluchtig, niet-polair oplosmiddel dat in de tweede beker kan worden gebruikt.
- Aceton is ook een relatief veilig organisch oplosmiddel. Omdat het echter een vluchtige stof is, moet het uit de buurt van vuur worden gehouden en met handschoenen en een beschermend masker worden behandeld.
-

Giet dezelfde hoeveelheid substantie in de twee bekers. Giet een deel van de gekozen stof in de twee containers en zorg ervoor dat u gelijke hoeveelheden gebruikt voor consistentie. Begin met het toevoegen van 10 tot 20 ml substantie in elk bekerglas.- U kunt bijvoorbeeld 20 ml isopropylalcohol aan elke container toevoegen.
-
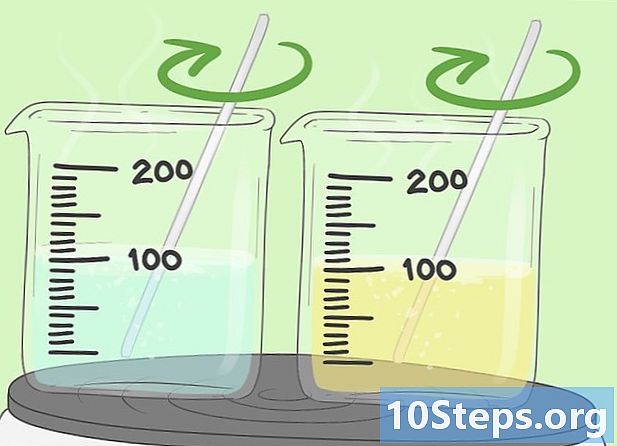
Mix of verwarm beide oplossingen. Mogelijk moet u de oplosmiddelen verwarmen of mengen zodat de stoffen op elkaar inwerken. Als dit het geval is, moeten beide oplosmiddelen in dezelfde mate worden geroerd en verwarmd. Vergeet niet dat het verwarmen van organische oplosmiddelen, zoals tolueen, gevaarlijk kan zijn. Wees zeer voorzichtig bij het hanteren ervan.- Als u isopropylalcohol gebruikt, meng dan de oplossing om deze te activeren. U hoeft het niet te verwarmen.
- Gebruik een hete plaat om de mengsels langzaam te verwarmen. Zet geen organische oplosmiddelen op het vuur.
-

Laat de bekers afkoelen. Laat de mengsels afkoelen zodra de stoffen een interactie aangaan met een of beide oplosmiddelen. Dit scheidt de stoffen van de oplosmiddelen als ze niet compatibel zijn, naast het vergemakkelijken van de hantering van de monsters. -

Bekijk de resultaten. Controleer of een vaste of vloeibare stof scheidt van het oplosmiddel. Als dit het geval is, betekent dit dat het onverenigbaar is met dit oplosmiddel. Moleculen die polair zijn, zijn compatibel met polaire oplosmiddelen en niet-polaire moleculen met apolaire oplosmiddelen. Daarom is elke stof die oplost in water polair. Stoffen die niet in water oplossen maar compatibel zijn met tolueen, aceton, benzine of andere niet-polaire oplosmiddelen zijn echter ook niet-polair.- Zodra de twee bekers zijn gedecanteerd, zal de isopropylalcohol volledig in het water oplossen, maar zal een laag van de plantaardige olie in de tweede beker vormen. Dit betekent dat isopropylalcohol polair is.
Methode 3 Voer elektromagnetische compatibiliteitstests uit
-

Plaats de stof in de buurt van een magneet. Je kunt zien of een stof polair is of niet door een magneet of object te benaderen dat aan een aanzienlijke magnetische lading is blootgesteld. Leg de stof op een vlak oppervlak en breng de magneet dichterbij zonder hem aan te raken. -

Zoek naar interactie. Als de magneet door de stof wordt aangetrokken of afgestoten, betekent dit dat hij polair is. De afwezigheid van reactie betekent echter niet dat de stof apolair is. Sommige polaire moleculen zijn niet gepolariseerd genoeg om te interageren met een zwakke magneet.- Als u bijvoorbeeld een magneet met een waterstraal nadert, verandert de vloeistof van richting, wat een duidelijke reactie op het elektromagnetische veld aangeeft.
-

Doe de stof in de magnetron. Magnetrons gebruiken hoogfrequente elektromagnetische straling om voedselmoleculen te roteren, waardoor wrijving en warmte ontstaan. Plaats de polariteit van een stof in de magnetron.- Plaats geen metalen, brandbare of explosieve materialen in de magnetron.
- Wanneer het in de magnetron wordt geplaatst, wordt het water warm, wat betekent dat het polair is.
- Als je babyolie in de magnetron doet, zul je zien dat het niet erg goed lijkt te verwarmen. Het betekent dat ze niet polair is.
-

Let op de stof. Kijk of het heet wordt en er tekenen zijn van smelten of vervormen. Als de magnetron de structuur van de stof verandert, betekent dit dat deze polair is.- Schakel de magnetron in. Bij blootstelling aan elektromagnetische straling beginnen de moleculen van de stof te draaien. Je zult dit fenomeen niet kunnen zien, maar het betekent dat het polair is. Als dit niet het geval is, zal het zeer weinig veranderen in de magnetron.


